近年来,CRISPR/Cas9技术在作物研究中取得了重要进展。然而,由于农业重要性状大多是定量性状,因此编辑启动子以调控基因表达强度变得十分重要。真核生物启动子由核心启动子区域和上游顺式调控元件(CREs)组成。通过靶向多个CREs来实现基因表达的改变通常是耗时的。相反,核心启动子区域中的突变却可以引起下游基因转录本的丰度显著变化。然而,但受限于序列特征,常用的CRISPR系统通常难以用于核心启动子编辑。最近发现的FrCas9与TATA PAM兼容,特别是与核心启动子TATA盒序列兼容。然而,FrCas9的活性及其在植物中的编辑模式尚未确定。
近期,安徽省农业科学院水稻研究所李娟与安徽农业大学魏鹏程团队在aBIOTECH发表了题为“Developing a CRISPR/FrCas9 system for core promoter editing in rice”的研究论文。研究团队设计了一种独特的FrCas9系统,并利用该系统在水稻中进行基因编辑,展示了其编辑植物核心启动子区域的潜力。

为了验证FrCas9系统的核心启动子编辑能力,作者使用TATA盒序列作为PAM,在Nipp(Oryza sativa L.cv Nipponbare)对白叶枯病菌(Xoo)易感基因OsSWEET13的近端启动子上设计sgRNA。此外,为了直接监测编辑活性,设计了一个sgRNA以靶向水稻PDS基因。在48个PDS转基因植株中,获得了六个白化植株,表明FrCas9系统在水稻中具有活性。
为了评估FrCas9系统编辑TA丰富序列时的潜力以及在水稻中的编辑表现,作者在水稻PDS基因位点上设计了16个包含所有可能的5'-NNTA-3' PAM的sgRNA,通过对稳定转化水稻愈伤组织的高通量测序表明,FrCas9系统编辑效率范围从1.1%到35.3%,表明FrCas9的高PAM兼容性。FrCas9系统在TGTA、TATA和AGTA PAM位点编辑效率较高,分别达到35.3%、33.8%和32.1%,这与NNTA PAM的第二个核苷酸偏好为R(A/G)的假设一致。
为了进一步测试FrCas9的核心启动子编辑能力,作者设计了一个带有TGTA PAM的sgRNA,靶向水稻Waxy(WX)基因启动子中非典型TATA(TACAAAT)序列。利用FrCas9编辑获得了WXiA和WXiT纯合编辑植株,纯合/双等位突变效率为50%。突变植株中WX表达量显著下调,导致了直链淀粉含量(AC)显著下降。同时,作者使用TATA为PAM的两个相向靶点,实现了FrCas9介导的双向编辑,在核心启动子区产生多重突变和小片段精确缺失。此外,构建了源自FrCas9的碱基编辑器A3A-FrBE3和FrABE8e,并在T0转基因植株中的评估其性能,结果显示其具有较高编辑高精度。
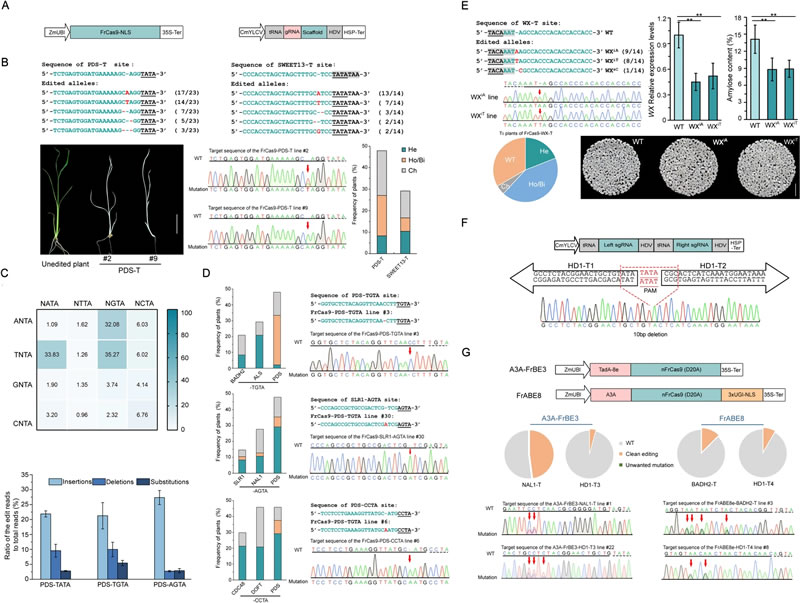
该研究在植物中建立了FrCas9介导的基因敲除和碱基编辑系统,并实现功能基因核心启动子的高效编辑,为基因表达的微调和新种质的创制提供了技术支撑。
Wang H, Ding J, Zhu J, et al, et al. Developing a CRISPR/FrCas9 system for core promoter editing in rice[J]. aBIOTECH, 2024: 1-7.
北大荒垦丰种业-泽泉科技生物技术与表型服务中心是由北大荒垦丰种业股份有限公司和上海泽泉科技股份有限公司共同建设的开放式高通量植物基因型-表型-育种服务平台。中心建立了基因克隆和载体平台、作物转化系统、基因型分析平台、表型鉴定分析平台、数据分析和利用平台等现代化生物技术和信息支持平台,是定位于为植物科研和作物育种提供植物基因型-表型-育种数据分析的科研服务平台。

相关阅读:
